研究领域:生物医学光学
主要从事基于纳微光学技术的细胞成像与操控研究,包括超分辨光学成像及应用(注重实验)、细胞光刻图案化操控(注重理论建模分析)、微流控生物芯片检测(注重实验)、超分辨数据处理与分析(注重数据建模分析)等生物物理交叉领域的科学研究。
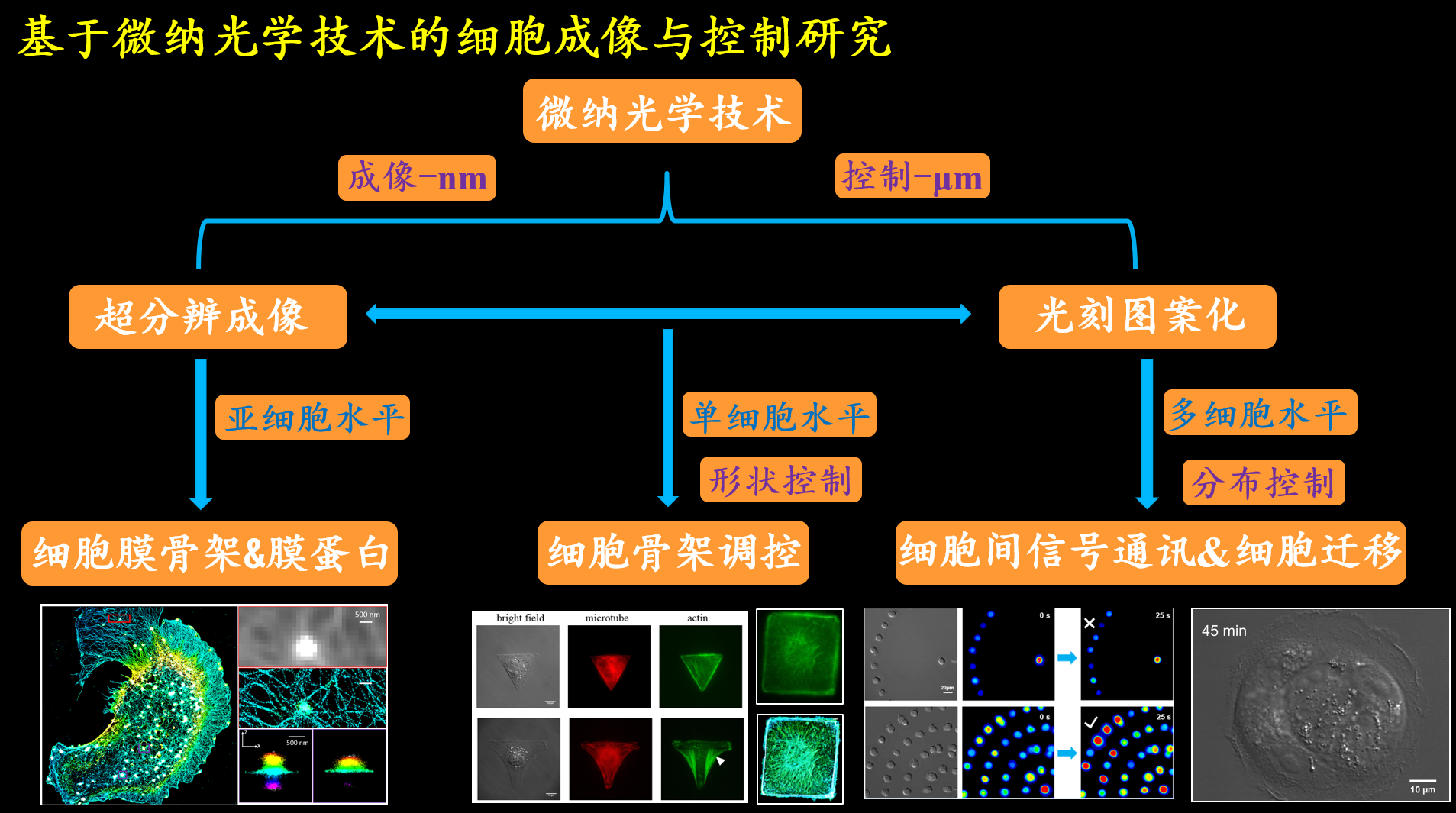
(1)发展先进光学成像技术(如超分辨成像技术),进一步提高成像分辨率,并在亚细胞水平研究细胞骨架、细胞膜蛋白精准时空组织特性等
a)搭建新型双模态超分辨成像系统,推进分辨率至10nm以内;
b)发展单分子定位超分辨成像相关的深度学习、定位算法、图像分析与处理手段;
c)基于超分辨成像研究细胞膜骨架、肿瘤免疫逃避相关膜蛋白组织特性等前沿生物学问题。
一百多年前德国物理学家Abbe指出由于光的波动性和衍射效应,使得远场成像系统横向分辨率存在约200 nm的极限,导致人们无法有效观测纳米尺度的生命现象。这一限制终于在21世纪初被打破,诞生了两大类超分辨荧光显微成像技术:1)基于激发光源改造(也称点扩散函数工程,Point-Spread-Function engineering,PSF engineering)技术的受激发射损耗显微术(STimulated Emission Depletion microscopy, STED)和结构光照明显微术(Structured Illumination Microscopy, SIM);2)基于单分子定位技术的光激活定位显微术(Photo-Activation Localization Microscopy, PALM)和随机光学重建显微术(STochastic Optical Reconstruction Microscopy, STORM)。这些超分辨成像技术使得远场成像横向分辨率轻松达到了百纳米以下,进而大大丰富了显微镜对细胞微纳结构与功能的研究。
2014年瑞典皇家科学院宣布将诺贝尔化学奖授予了Eric Betzig、Stefan Hell以及William Moerner三位科学家,以表彰他们在“发展超高分辨荧光显微镜”上的贡献。
目前我们已经搭建一套先进的STORM超分辨成像系统,横向分辨率达到25nm,纵向分辨率50nm。

自主搭建的STORM超分辨成像系统

细胞微管骨架超分辨成像与普通成像
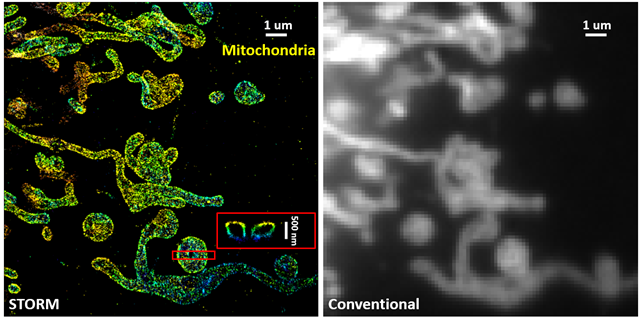
细胞线粒体的超分辨成像与普通成像

细超分辨图像的识别与定位算法建立
(2)发展先进细胞体外操控手段(如光刻图案化技术)多细胞水平研究细胞间相互作用、群体迁移特性、细胞间通讯等复杂系统形成过程与机制。
个体的力量是有限的,团结的群体力量才是强大的。如细菌依靠通过群体效应感染宿主,人体免疫系统则通过群体效应抵御病菌入侵,鸟群通过群体效应防止个体被捕食。而群体效应的发挥不是个体数量简单的、散兵游勇式的堆砌,而是依靠具有特定数量范围的、智能个体基于局部信息自发演化做出行动的复杂系统实现的。复杂系统科学魅力在于看似随机的微观个体可通过耦合跨越时空尺度形成“有序”的宏观结构与功能。因此,如何理解并操控复杂系统,实现“秩序”行为是重要的科学问题。
细胞是生命的基本单位,个体具有一定的智能性,彼此存在较强的耦合作用,可形成各种有序的多细胞复杂生命现象,是理想的复杂系统模型。
2021年的诺贝尔物理学奖授予日本籍科学家Syukuro Manabe、德国科学家Klaus Hasselmann和意大利科学家Giorgio Parisi,以表彰他们“对人类理解复杂系统的开创性贡献”。
a)多细胞协同运动高等生命体形成有序的结构保障。拟发展光刻技术,在基底上实现细胞分布的图案化控制,研究细胞群体性迁移行为,如使得细胞发生协同迁移行为,以“自上而下”和“自下而上”策略,对该行为进行理论建模,与实验相辅相成,揭示细胞群体协同迁移现象及机制,为理解和操控复杂系统的秩序行为提供新方法新思路;
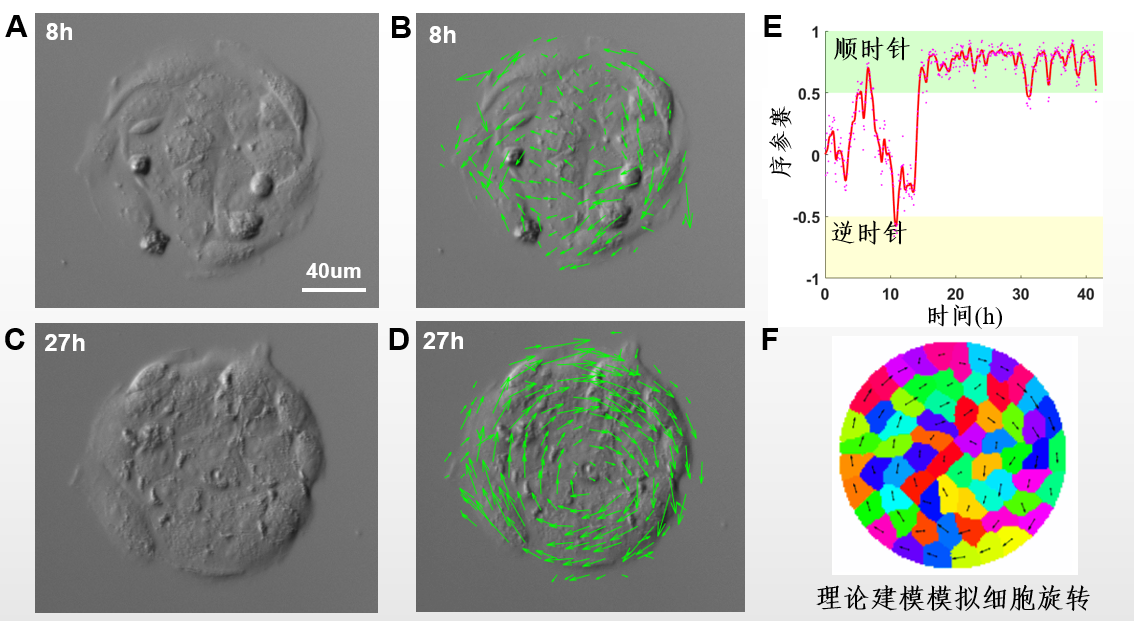
基于光刻图案化技术群体细胞协同运动建模与分析
b)伤口愈合涉及细胞迁移、细胞增殖、细胞间相互作用等,是一个典型的复杂系统中不同个体之间相互协作的复杂过程。拟利用光刻图案化技术创造不同的伤口愈合环境,发展基于PIV算法的伤口愈合群体迁移数据分析方法,研究不同伤口愈合过程的表观特性。再基于Ising模型发展新的细胞迁移理论模型如Potts模型,引入细胞增殖和“领导者”细胞形成等参量,建立伤口愈合模型,揭示伤口愈合过程表观特性与调控机理。

群体细胞迁移理论模型

基于光刻图案化技术的伤口愈合建模与分析
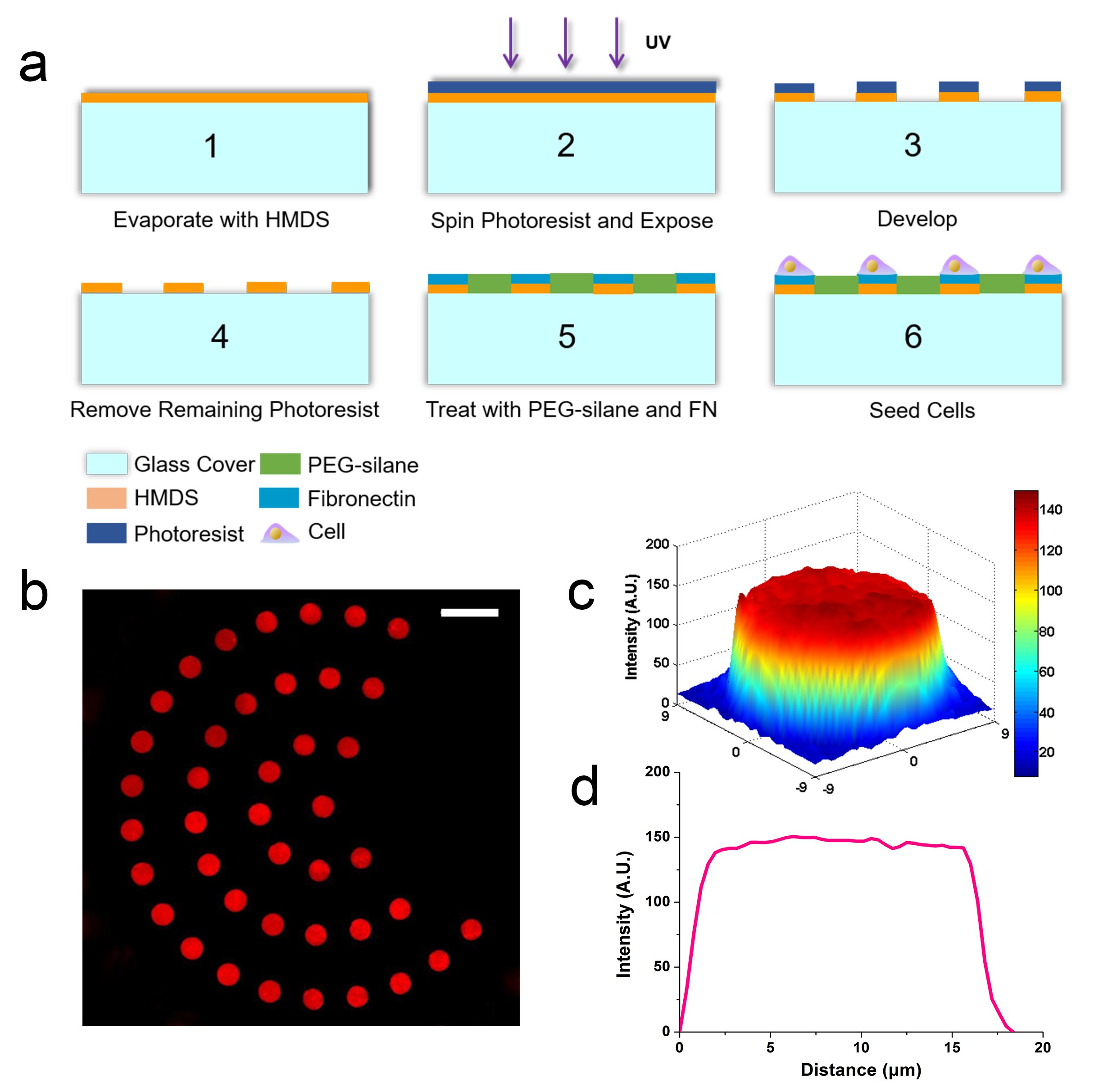
光刻图案化技术流程
(3)基于微流控技术,发展微型芯片检测技术,如研究红细胞变形性,为精准医疗和家庭化血液检测提供新颖解决方案。
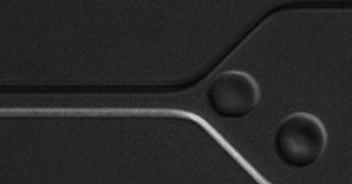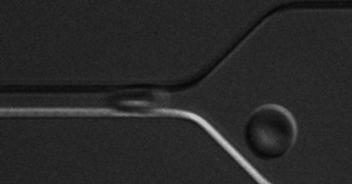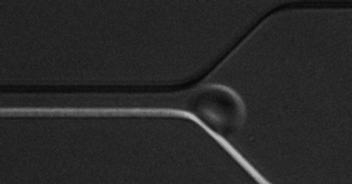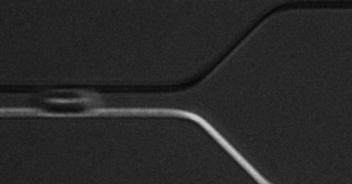

基于光刻图案化技术的细胞微流控芯片
(4)基于倒置显微镜系统,发展单细胞水平的光辐照技术,定量研究紫外光对血细胞等的影响,为临床上合理有效使用紫外线照射自血回输疗法以及深入认识太阳紫外光对人体健康影响提供新的思考视角。
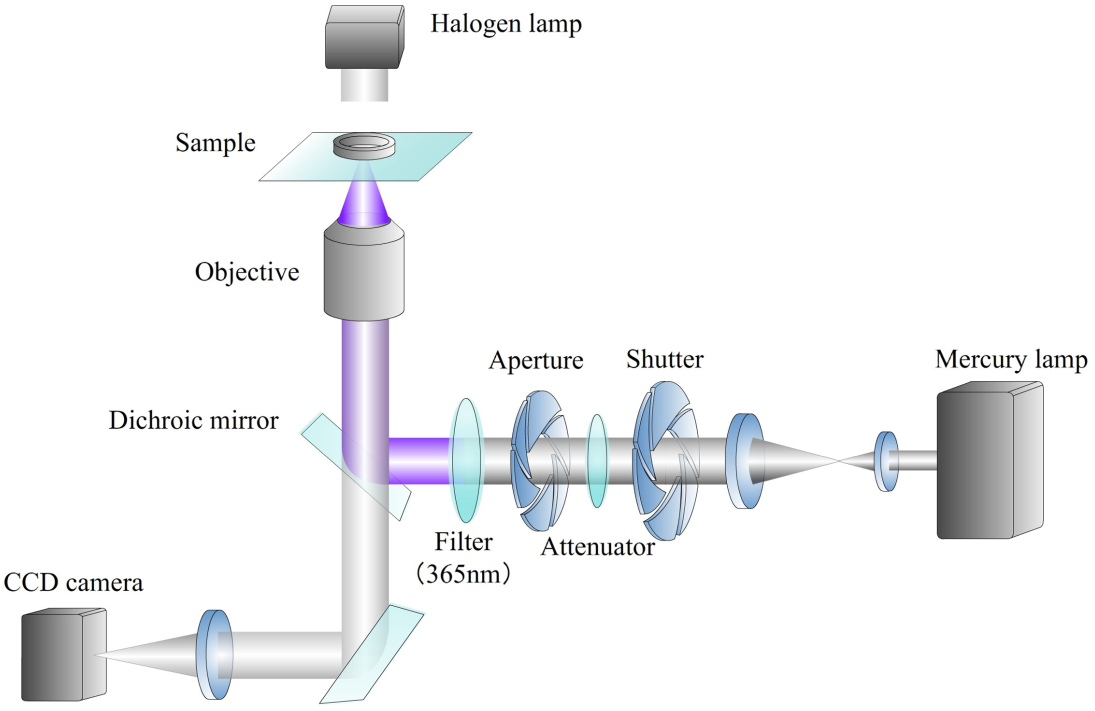
基于倒置荧光显微镜的紫外辐照系统

紫外辐照(红色圆圈)可有效保护红细胞形态